Introdução
O mieloma múltiplo (MM) caracteriza-se pela proliferação clonal de plasmócitos que infiltram a medula óssea. Essas células têm capacidade de produzir imunoglobulinas (Ig) G, A, D, E e raramente M, ou partes dessas, as cadeias leves k e l. Ao infiltrar a medula óssea, suprimem a produção normal dos elementos do sangue, além de liberarem substâncias que levam ao aumento da reabsorção óssea, resultando em destruição extensa do esqueleto, com lesões osteolíticas, osteoporose e fraturas.
Epidemiologia
Malignidade mais comum do osso, representando 43% das malignidades primárias do osso. Seu pico de incidência é observado na quinta à sétima décadas com uma predominância masculina de 2:1, raça negra.
Etiologia
A etiologia do MM não está estabelecida. A incidência aumentada de MM em sobreviventes japoneses da bomba atômica sugere uma associação com radiação ionizante. Vários estudos associam o risco de mieloma à exposição a pesticidas, como por exemplo as dioxinas. Numerosos vírus e outros agentes infecciosos têm sido relacionados à patogênese do mieloma múltiplo, mas os mecanismos ainda não foram elucidados. É relatada a ocorrência de mieloma múltiplo em grupos familiares de dois ou mais parentes de primeiro grau e em gêmeos idênticos.
Patogênese
Nenhum simples defeito molecular justifica a patogênese do MM. A célula do mieloma apresenta baixo índice de proliferação. Ocorrem anormalidades na sinalização, nos mecanismos de apoptose e microambiente da medula óssea. Estas alterações podem resultar em ativação e produção de citoquinas que estimulam a proliferação de células do mieloma e aumentam sua sobrevida. Das citoquinas, a interleucina-6 é a mais importante na proliferação e sobrevida da célula do mieloma. Outras citoquinas e fatores de crescimento produzidos pelas células do mieloma e do estroma, que mantém o mieloma, incluem a interleucina-1b, fator de crescimento do endotélio e fator de necrose tumoral-a. Há uma relação patológica e sinérgica entre as células do mieloma e as células do microambiente da medula óssea.
Manifestações clínicas
Anemia, fadiga e dores ósseas constituem a tríade que sugere o diagnóstico de mieloma múltiplo, embora outros achados sugiram também a doença, como fraturas patológicas, hipercalcemia, insuficiência renal, hiperglobulinemia e proteinúria de Bence-Jones.
Dor óssea é o sintoma mais freqüente, ocorre em 50 a 90% dos pacientes, geralmente localizada nas costas e tórax e, com menos freqüência, nos membros. A dor é induzida pelo movimento. Dores persistentes podem indicar fratura ou compressão de raiz nervosa. A dor é devida à proliferação das células do mieloma que produzem fatores ativadores do osteoclasto, causando um aumento da atividade osteoclástica, levando a intensa reabsorção óssea, com perda óssea difusa, lesões líticas e fraturas. O principal local de acometimento é o esqueleto axial. Pode haver redução da altura do paciente de até vários centímetros devido ao colapso vertebral. A compressão da medula espinhal ocorre em até 10% dos pacientes.
A anemia ocorre em 60% dos pacientes ao diagnóstico, é uma característica típica do mieloma, e tem como causa, além do deslocamento físico dos precursores de eritrócitos da medula óssea, a inibição específica da eritropoiese pelas citocinas do microambiente. O comprometimento renal é mais um fator que pode contribuir para a anemia.
Comprometimento renal em mieloma múltiplo é comum, e sua incidência relatada é de 20 a 60% ao diagnóstico. A alteração renal ocorre devido às cadeias leves monoclonais filtradas, que se precipitam e provocam uma disfunção tubular, formando cilindros intratubulares com conseqüente obstrução destes. A hipercalcemia, desidratação e infecção são os fatores mais importantes que precipitam em 50 a 95% a insuficiência renal. Outro fator que pode contribuir é o uso de drogas antiinflamatórias não-esteróides, freqüentemente utilizadas para a dor. Ocorre amiloidose em 10 a 15% dos pacientes, podendo produzir síndrome nefrótica e/ou insuficiência renal.
Infecção é uma importante causa de morbidade e mortalidade em pacientes com mieloma, ao diagnóstico e durante a evolução. Cerca de 25% dos pacientes morrem de infecção nos primeiros 6 meses após o diagnóstico. A incidência de infecções em pacientes com mieloma múltiplo é 15 vezes maior do que em indivíduos normais. Os patógenos mais comuns são o Streptococcus pneumoniae e o Haemophilus influenzae; entretanto, na atualidade, os microrganismos Gram-negativos são responsáveis por mais de 50% das infecções. A propensão à infecção resulta do comprometimento da resposta humoral, deficiência de imunoglobulinas normais e neutropenia.
Entre 20 e 30% dos pacientes apresentam hipercalcemia ao diagnóstico. Os sintomas são polidipsia, náusea, irritabilidade, confusão mental e pré-coma.
A síndrome da hiperviscosidade ocorre em 6% dos pacientes. Os sinais mais freqüentes são decorrentes de alterações da coagulação, principalmente sangramentos de mucosas. Alterações neurológicas como cefaléia, tonturas e coma são comuns. Sintomas de insuficiência cardíaca podem se manifestar.
Diagnóstico
Os critérios para o diagnóstico das gamopatias monoclonais, mieloma múltiplo e doenças relacionadas foram recentemente revisados por Kyle e colaboradores em 2003, e definiram que os critérios para o diagnóstico de:
– mieloma múltiplo assintomático consistem em medula óssea com mais de 10% de plasmócitos ou plasmocitoma, além de proteína monoclonal > 3 g/dL no sangue ou urina; sem presença de anemia, creatinina > 2 mg/dL, hipercalcemia, lesões ósseas líticas ou osteoporose com fraturas;
– mieloma múltiplo sintomático compreendem os achados descritos e a presença de anemia e/ou creatinina > 2 mg/dL e/ou hipercalcemia e/ou lesões líticas ou osteoporose com fraturas.
Critérios diagnósticos maiores e menores:
Maiores: PTN bence-jones, IgG>3,5, plasmocitos>30%, plasmocitoma
Menores: hipergamaglobulinemia<3,5, plasmocitos>10%…
Achados laboratoriais
A anemia normocítica normocrômica é o achado mais freqüente em pacientes com mieloma múltiplo, ocorrendo em 2/3 dos pacientes ao diagnóstico.
A eletroforese de proteínas séricas apresenta um pico monoclonal em 80% dos pacientes. O componente monoclonal mais freqüente é IgG em 53% dos casos, IgA em 20%, cadeia leve apenas em 17%, IgD 2% e gamopatia biclonal em 1%; e em 7% dos casos não se detecta proteína monoclonal ao diagnóstico.
A imunofixação da urina detecta proteína monoclonal em 75% dos pacientes. A relação k/l é de 2:1 em 98% dos pacientes com mieloma múltiplo.
O aspirado da medula óssea dos pacientes com mieloma múltiplo mostra um aumento dos plasmócitos, que constituem 10% ou mais das células nucleadas. O comprometimento da medula óssea pode ser mais focal do que difuso, sendo necessário muitas vezes repetir o exame com punções em diferentes locais, para se estabelecer o diagnóstico.
Achados radiológicos
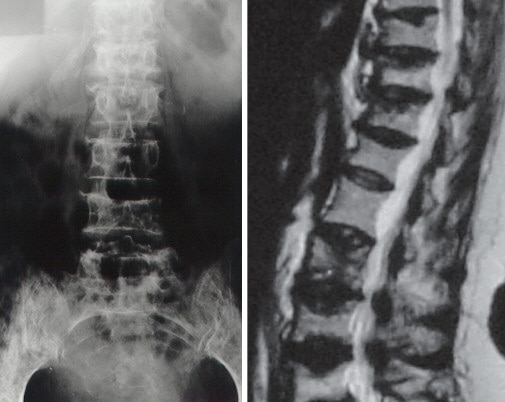
Os estudos radiográficos convencionais continuam sendo universalmente utilizados na avaliação inicial de pacientes com mieloma múltiplo. As radiografias mostram alterações ósseas, que consistem em lesões líticas em saca-bocado, osteoporose ou fraturas em 75% dos pacientes. Os locais mais freqüentes de comprometimento são as vértebras, crânio, arcos costais, pelve e porção proximal do úmero e do fêmur.
A cintilografia óssea com tecnécio-99m geralmente altamente sensível na detecção de metástases ósseas de câncer de mama e próstata, não apresenta a mesma sensibilidade em mieloma. Estudos comparativos têm demonstrado que as radiografias convencionais detectam mais lesões líticas (sensibilidade de 74-82%) do que a cintilografia óssea (sensibilidade 37-60%).
A ressonância magnética melhorou significantemente a avaliação de pacientes com mieloma. Além de ser útil na investigação de pacientes que apresentam dores ósseas, mas não apresentam alterações à radiografia convencional, permite avaliar a extensão da infiltração da medula óssea, auxiliando na avaliação da resposta ao tratamento.
A tomografia computadorizada é altamente sensível para identificar lesões líticas do esqueleto, mesmo antes de serem visíveis à radiografia. Entretanto, não é usada de rotina devido à superioridade da ressonância magnética, além do fato de não alterar o estadiamento ou decisões terapêuticas quando utilizada além da radiografia.
Diagnósticos diferenciais
Doença de Paget, Osteoporose, Osteomielite, Metástases.
Tratamento
Antes de iniciar o tratamento para mieloma múltiplo, é importante distinguir entre mieloma assintomático (indolente ou smoldering) e mieloma sintomático (ativo), que requer tratamento.
Aproximadamente 20% dos pacientes com mieloma múltiplo são assintomáticos e não necessitam receber tratamento imediatamente, mas devem ser monitorados cuidadosamente. As indicações para terapia são: o desenvolvimento de anemia significativa, hipercalcemia ou insuficiência renal; a ocorrência de lesões ósseas líticas e o achado de plasmocitomas extramedulares.
Após a decisão de se iniciar a terapia, um planejamento a longo prazo deve ser estabelecido. Como o tratamento com altas doses de quimioterapia e resgate com células precursoras hematopoéticas (transplante autólogo) é aceito como uma importante modalidade terapêutica para pacientes abaixo de 65 anos, esquemas baseados em agentes alquilantes devem ser evitados antes da coleta de células precursoras hematopoéticas em pacientes candidatos a altas doses de quimioterapia.
O transplante autólogo está indicado a todos os pacientes com idade e desempenho adequado. Os pacientes que não preenchem esses critérios deverão receber quimioterapia em doses convencionais.
Quimioterapia Convencional
Após sua introdução, em 1962, o melfalano tem sido o agente quimioterápico mais utilizado para o tratamento de mieloma múltiplo. Quando associado à prednisona, atinge respostas objetivas em 50 a 60% dos pacientes. O melfalano pode ser administrado diariamente, em uma dose de 10 mg/m2 e prednisona 1 mg/kg/dia durante quatro dias, ambos por via oral, e repetir a cada 4 a 6 semanas.
Devido às falhas ao tratamento com melfalano e prednisona (MP), vários esquemas quimioterápicos têm sido utilizados. Entre esses, um dos melhores protocolos é o M2, que inclui vincristina, carmustina, melfalano, ciclofosfamida e prednisona (VBMCP). Em estudo do Eastern Cooperative Oncology Group (ECOG), a resposta objetiva foi de 72% para VBMCP e 51% para MP, mas a sobrevida média dos dois grupos não foi diferente.
A associação dos quimioterápicos vincristina 0,4 mg/dia e adriblastina 9 mg/m2/dia, em infusão contínua durante 96 horas e dexametasona 40 mg nos dias 1-4, 9-12 e 17-20 (VAD), foi introduzida em 1984 e tem sido utilizada como uma alternativa terapêutica. Embora não produza uma resposta global melhor que o esquema MP, essa combinação apresenta a vantagem de atingir boas respostas, sem prejudicar as células precursoras da medula óssea.
O mieloma múltiplo é uma doença de difícil tratamento, principalmente devido à resistência aos quimioterápicos. Aproximadamente 30 a 50% dos pacientes não respondem ao tratamento convencional de primeira linha e mesmo os que respondem, apenas 5% obtêm remissão completa, e a recidiva é inevitável.
Altas Doses de Quimioterapia
Para aumentar a sobrevida dos pacientes com mieloma múltiplo, quimioterapia em altas doses tem sido utilizada, nos últimos anos. O uso de agentes alquilantes em altas doses é seguido de resgate com células precursoras da hemopoese. Esse resgate pode ser sob forma de transplante autólogo ou alogênico. O benefício dessa estratégia terapêutica é que, com a administração de quimioterapia em altas doses, pode-se obter uma maior eliminação das células do mieloma e, dessa forma, atingir a remissão na maioria dos pacientes.
As células progenitoras do sangue periférico são preferíveis ao transplante de medula óssea, visto que o enxerto é mais rápido e há menos contaminação de células infundidas com células tumorais. A maioria dos pesquisadores prefere o esquema VAD como terapia inicial, uma vez que esses agentes não causam lesão das células primordiais hematopoéticas. São 3 a 4 ciclos de VAD ou programa semelhante durante três a quatro meses, para reduzir o número de células tumorais na medula óssea e no sangue periférico. A seguir, administra-se ciclofosfamida em altas doses, seguida do fator estimulante das colônias dos granulócitos, e procede-se à coleta das células primordiais periféricas. Pode-se efetuar, a seguir, o transplante; o paciente recebe melfalano em altas doses (200 mg/m2 são uma dose bem tolerada), ou um esquema semelhante de condicionamento, seguido da infusão das células precursoras do sangue periférico.
Com o transplante autólogo, a taxa de resposta varia de 70 a 90%, com sobrevida mediana de 4 a 5 anos. Em 1990, o “Intergroupe Français du Myélome” iniciou estudo que comparou dois grupos de pacientes, um grupo tratado com quimioterapia em altas doses, com transplante autólogo de células precursoras da hemopoese, e o outro grupo com quimioterapia convencional, e demonstrou que a taxa de resposta (81% versus 57%), resposta completa (22% versus 5%), sobrevida livre de evento aos 5 anos (28% versus 10%) e sobrevida global (52% versus 12%) foi favorável ao grupo tratado com transplante. Em análise atualizada com mediana de seguimento de 7 anos confirmou-se a superioridade do transplante autólogo com aumento da sobrevida livre de evento mediana (28 versus 18 meses) e sobrevida global (57 versus 44 meses). Entretanto, apesar dos resultados dos estudos mostrarem aumento da sobrevida com transplante autólogo, a curva de sobrevida não atinge platô, demonstrando que esse procedimento não tem potencial de cura.
O número de pacientes candidatos ao transplante alogênico é pequeno, 90 a 95% dos pacientes com mieloma múltiplo não podem receber transplante alogênico devido à sua idade, falta de irmão doador HLA-compatível e função renal, pulmonar ou cardíaca inadequada. Os argumentos favoráveis ao transplante alogênico são o potencial de erradicação da doença, por não reinfundir células malignas do mieloma durante o transplante e o efeito do enxerto versus mieloma.
Os argumentos a favor do transplante autólogo, para pacientes portadores de mieloma múltiplo, são a baixa taxa de mortalidade relacionada ao transplante, podendo incluir pacientes acima de 55 anos e, talvez com o duplo transplante, a possibilidade de erradicação da doença.
O uso de esquemas de condicionamento não-mieloablativos é uma alternativa (minitransplante alogênico) para pacientes com prognóstico desfavorável ou que recidivam após o transplante autólogo. O objetivo desse procedimento é conseguir o efeito enxerto versus mieloma com menor toxicidade do que com o transplante alogênico. No estudo do grupo de Seattle com altas doses de melfalano (200 mg/m2) e transplante autólogo, seguido de condicionamento com baixas doses de radiação corpórea total e transplante alogênico, os resultados preliminares demonstraram uma taxa de remissão completa de 60%, mortalidade relacionada ao transplante de 6% e sobrevida livre de progressão aos 13 meses de 83%.
Manutenção
Para tentar aumentar o tempo de duração da remissão e evitar a recidiva, há muitos estudos pesquisando várias drogas como tratamento de manutenção, dentre essas o interferon-alfa, prednisona, dexametasona, bortezomibe e talidomida. O benefício da terapia de manutenção ainda não está claro.
Novas Drogas
Novas estratégias terapêuticas não têm como alvo só a célula do mieloma, mas sim a medula óssea e seu microambiente. A demonstração da angiogênese aumentada na medula óssea, associada à atividade antiangiogênica da talidomida, levaram ao racional do uso da talidomida em pacientes refratários ao tratamento, obtendo 32 a 72% de respostas.
Associada à dexametasona, a taxa de resposta pode ser maior. Em pacientes recém-diagnosticados, a taxa de resposta é de 64%.
Outra droga com mecanismo de ação complexo que tem sido estudada é o bortezomibe (inibidor de proteassoma). Em estudo fase II (SUMMIT), com pacientes recidivados e refratários, a taxa de resposta global (remissão completa + remissão parcial + resposta mínima) foi de 35%, sendo 10% de remissão completa, e destas, 6% com imunofixação negativa. Em estudo fase III (APEX), 670 pacientes com mieloma múltiplo recidivados ou refratários foram randomizados para receber bortezomibe ou dexametasona; a taxa de resposta global foi de 38% versus 18%, o tempo mediano para progressão para o grupo que recebeu bortezomibe foi de 6,2 meses e para o grupo que recebeu dexametasona foi de 3,5 meses, a sobrevida global em 1 ano no braço que recebeu bortezomibe foi de 80% e no braço que recebeu dexametasona foi de 66%. Muitos estudos com bortezomibe isolado ou associado a outros quimioterápicos estão em andamento para pacientes recidivados e refratários, para pacientes recém-diagnosticados, e também como tratamento de manutenção.
Radioterapia
A radioterapia paliativa pode ser utilizada, em uma dose de 20 a 30 Gy, e deve ser limitada aos pacientes portadores de mieloma múltiplo que apresentam dor incapacitante e processo focal bem definido, o qual não respondeu à quimioterapia.
Tratamento de suporte
Bisfosfonatos
Pertencem a uma classe de drogas que inibem a atividade osteoclástica, diminuindo a reabsorção óssea, reduzindo as complicações ósseas, além de corrigir com eficácia a hipercalcemia. Alguns estudos pré-clínicos têm demonstrado atividade antitumoral dos bisfosfonatos. O ácido zoledrônico, pamidronato e clodronato são os bisfosfonatos que têm sido utilizados em mieloma múltiplo. O ácido zoledrônico é superior no controle da hipercalcemia.
Eritropoetina
Vários estudos demonstraram que a eritropoetina recombinante humana melhora ou normaliza a anemia associada ao mieloma na maioria dos pacientes. Deve ser considerada a sua utilização dentro do esquema terapêutico.
Antibioticoterapia
Devido à alta freqüência de infecções em pacientes com mieloma, o uso de antibióticos deve ser imediatamente instituído se houver suspeita de infecção ativa. O uso de antibióticos profiláticos é controverso.
Plasmaférese
Indicada em pacientes com síndrome de hiperviscosidade (sangramento oronasal, borramento visual ou insuficiência cardíaca).
Prognóstico
A sobrevida de paciente com mieloma múltiplo varia de poucos meses a mais de dez anos. Esta heterogeneidade está relacionada às características do próprio mieloma e do hospedeiro. A identificação de fatores que influenciam o prognóstico é muito importante para predizer resultado, auxiliar na escolha do tratamento e estratificar adequadamente os pacientes em estudos clínicos.
Uma forma de avaliação do estadiamento ao diagnóstico é o sistema desenvolvido por Durie e Salmon (1975). Combinando cinco fatores (calcemia, nível de hemoglobina, concentração de proteína monoclonal sérica, proteinúria e lesões ósseas), mieloma é dividido em três grupos que correlacionam com a sobrevida:
– estádio I (maior que 61 meses)
– estádio II (50 meses)
– estádio III (26 meses).
Incluindo avaliação da função renal, se creatinina < 2 mg/dl, subdividido como A, e valores elevados como B. Muitos estudos validaram os dados deste sistema de estadiamento.
O nível de b2-microglobulina constitui o fator prognóstico isolado mais importante no mieloma múltiplo previamente não tratado. Em 147 pacientes tratados com quimioterapia convencional, os pacientes com b2-microglobulina abaixo de 6 mg/dl apresentaram taxa de sobrevida aos 5 anos de 53%, enquanto a taxa dos que apresentaram valores elevados foi de 18%.
Embora os estudos citogenéticos em mieloma sejam difíceis devido à baixa taxa de proliferação dos plasmócitos, fornecem informações prognósticas importantes e independentes. A extensão e a freqüência das anormalidades cariotípicas estão relacionadas com o estádio, o prognóstico e a resposta ao tratamento. No estádio I ocorrem aproximadamente 20% de alterações citogenéticas, 60% no estádio III e, acima de 80%, nos tumores extramedulares.
As anormalidades citogenéticas mais comuns observadas em mieloma múltiplo comprometem os cromossomos 1 e 14. No cromossomo 1, entre 40 e 50% dos casos ocorrem alterações numerosas e complexas. O comprometimento do cromossomo 14 ocorre em 20 a 25% dos pacientes.
Em 2003, Fonseca et al. mostraram que as diferentes translocações têm implicações prognósticas diferentes, pacientes com t(4;14)(p16.3;q32) e com t(14;16)(q32;23) apresentam doença muito agressiva e sobrevida curta. Já pacientes com t(11;14)(q13;q32) têm prognóstico muito melhor.
A monossomia do cromossomo 13 encontrada em 33% dos pacientes foi associada a menor sobrevida (mediana de 14 meses versus 60 meses; p=0.03).
Muitos outros fatores prognósticos têm sido identificados em pacientes com mieloma múltiplo. Alguns autores têm combinado fatores prognósticos e proposto vários sistemas de estadiamento. Entretanto, nenhum destes ainda substituiu o estadiamento de Durie-Salmon.
Recentemente, o International Myeloma Working Group, com o objetivo de desenvolver um sistema de estadiamento simples e confiável, que pudesse ser aplicado internacionalmente para classificação e estratificação dos pacientes com mieloma múltiplo, identificou três grupos de riscos. Este novo sistema de estadiamento, o “International Staging System” (ISS), consiste em :
– estádio I – ß2 microglobulina < 3.5 mg/L e albumina > 3.5 g/dL (sobrevida mediana 62 meses)
– estádio II – nem I nem III (mediana 44 meses);
– estádio III – ß2 microglobulina > 5.5 mg/L (mediana 29 meses).



tenho todos os sintomas os medico não descobriram por falta de exames adeguados muito caro o SUS aqui só pra quem eles querem pois tem mais de um ano que fraturei a coluna devido osteoporose segundo radiografia computadorisada o medico solicitou uma citilografia ossea e não tenho dinheiro pra pagar custa 858.00 em Araguaina To não posso trabalhar tenho 64 anos recebo auxilio donça pra isso tenho que pagar Advogado 30% de 1.666.00 pago aluguel e não da pra me alimentar nem comprar os medicamentos Ibandronato de sodio 150 mg, fosamax D 70 mg, velus e Extima muito caro sinto muitas dores só alivia com analgesico forte injetavel não sei por onde começar sem grana e sem apoio do SUS moro em Carolina Maranhão
José, existem órgãos fiscalizadores e reguladores, é onde deve começar, a corregedoria da saúde e a defensoria pública de saúde da sua região.