As Distrofias Musculares Progressivas (DMPs) englobam um grupo de doenças genéticas, que se caracterizam por uma degeneração progressiva do tecido muscular . Até o presente momento tem-se o conhecimento de mais de trinta (30) formas diferentes de DMP’s, algumas benignas e outras mais graves, que podem atingir crianças e adultos de ambos os sexos. Todas atacam a musculatura, mas os músculos atingidos podem ser diferentes de acordo com o tipo de DMP.
Os principais tipos de DMP’s são: Distrofia Muscular do tipo Duchenne (DMD), Distrofia Muscular do tipo Becker (DMB), Distrofia Muscular do tipo Cinturas (DMC), Distrofia Miotónica de Steinert (DMS) e Distrofia Muscular Facio-Escápulo-Umeral (FSH), sendo que a mais grave e mais comum é a Distrofia Muscular Duchenne (DMD). Esta doença atinge apenas meninos, numa incidência de 1 para cada 3.500 nascimentos masculinos.
Distrofia Muscular de Duchenne (DMD)
“Eu pensei que a humanidade já estava infringida de males suficientes…e não parabenizo o Senhor pelo novo presente que a humanidade ganhou”.
Esse pronunciamento dramático foi feito por Guillaume Duchenne, neurologista francês que primeiro escreveu a doença em 1868. Referia-se a descrição histórica de uma particular doença neuromuscular progressiva e destrutiva, afetando principalmente meninos. Por um século a doença seria conhecida como uma distrofia. Depois da observação de Duchenne, essa condição seria conhecida e comumente chamada como Distrofia Muscular de Duchenne.
Descrição da doença
Distrofia muscular é uma doença de origem genética, cuja característica principal é o enfraquecimento e posteriormente a atrofia progressiva dos músculos, prejudicando os movimentos e levando o portador a uma cadeira de rodas. Ela é uma doença motora e se diferencia das demais porque qualquer esforço muscular que cause o mínimo de fadiga, contribui para a deterioração do tecido muscular. Isto porque o defeito genético ocorre pela ausência ou formação inadequada de proteínas essenciais para o funcionamento da fisiologia da célula muscular.
Aumento de volume das panturrilhas, escápulas aladas e hiperlordose.
O tipo Duchenne afeta essencialmente o sexo masculino. Também é a forma mais severa de distrofia muscular, até a idade adulta, o paciente estará profundamente debilitado, tanto fisicamente devido à fraqueza estabelecida pela fragilidade óssea, quanto psicologicamente, já que ocorre um aparente desânimo devido ao próprio estado de saúde.
A manobra clássica de Gowers. Para levantar-se do chão o paciente usa as mãos para ‘escalar’ as próprias pernas.
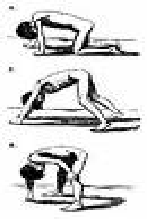
O homem com esta doença não tem como se reproduzir e esta é a razão principal de as mulheres não apresentarem a Distrofia Muscular de Duchenne. A transmissão se faz por traço recessivo ligado ao sexo e a taxa de mutação é alta. Geralmente, o quadro só é notado quando a criança começa a andar. As primeiras características são o aumento do volume das panturrilhas, decorrente do grande esforço que os gastrocnêmios são submetidos para compensar o déficit dos músculos ântero-laterais das pernas, para auxiliar o equilíbrio na marcha que estes pacientes apresentam.
Aspectos genéticos
O gene defeituoso é o que sofreu uma alteração em sua estrutura, que o impede de exercer sua função normal na célula, causando doenças que podem ser transmitidas hereditariamente.
O gene defeituoso pode causar uma mutação. Se o gene “mutado” for transmitido aos descendentes causará sérias doenças. As mutações são as causadoras das distrofias musculares.
A herança recessiva ligada ao X
Uma mutação ligada ao X expressa-se fenotipicamente em todos os homens que a recebem, mas apenas nas mulheres que são homozigóticas para a mutação. Mulheres heterozigóticas podem expressar o fenótipo (considerando a Hipótese de Lion).
O gene de um distúrbio ligado ao X às vezes está presente em um pai e em uma mãe portadora e, então, as filhas podem ser homozigóticas afetadas.
Critérios da herança recessiva ligada ao X
A incidência do fenótipo é muito mais alta em homens do que em mulheres. O gene responsável pela afecção é transmitido de um homem afetado para todas as suas filhas. Os filhos do sexo masculino de qualquer uma de suas filhas tem uma chance de 50% de herdá-lo. O gene jamais se transmite diretamente do pai para o filho, mas sim de homem afetado para todas as suas filhas. As mulheres heterozigóticas geralmente não são afetadas, mas algumas apresentam afecção com intensidade variável. Um exemplo de herança recessiva ligada ao X é a Distrofia Muscular de Duchenne (DMD), que é típica e letal em homens.
A DMD tem uma taxa de mutação calculada maior do que as outras doenças genéticas. Há vários estudos onde se prevê que 1/3 dos casos é de mutantes novos e 2/3 dos pacientes são de mães portadoras. A grande maioria das portadoras não exibe qualquer manifestação clínica. Há exemplos raríssimos de meninas com DMD. A DMD compreende 15% das mutações no lócus.
A DMD é uma doença genética causada por um gene defeituoso (que sofreu uma mutação genética), localizado no braço curto do cromossomo X, em uma região denominada Xp21. A mulher possui dois cromossomos X, enquanto o homem possui um cromossomo X e um cromossomo Y. Se uma mulher tiver em um dos seus cromossomos X a mutação genética que provoca a DMD, o outro cromossomo X (que não contém a mutação), será capaz de protegê-la dos efeitos do gene defeituoso. Por isso, os afetados pela DMD são sempre do sexo masculino e o gene defeituoso pode ser transmitido por mulheres portadoras assintomáticas.
No músculo normal as fibras têm diâmetro regular, e acomodam-se umas às outras tomando cortorno poligonal com ângulos arredondados. Os mionúcleos são periféricos, ocupando posição subsarcolemal.
Em cerca de 2/3 dos casos de DMD, a mutação responsável pela doença já está presente na mãe do paciente (portadora assintomática), que corre um risco de 50% de ter outros filhos de sexo masculino afetados. Em 1/3 dos casos, a mutação ocorre no menino afetado pela DMD, sem ter sido herdado pela mãe, ou seja, decorrentes de mutações novas. Nestes casos, dizemos que ocorreu uma mutação nova, e o risco de recorrência para futuros filhos é desprezível.
Além da fibrose, nota-se irregularidade no diâmetro das fibras musculares, havendo fibras desde atróficas até hipertróficas, isto é, maiores que as normais. As atróficas são provavelmente fibras cuja regeneração não foi bem sucedida ou que ficaram desnervadas. As hipertróficas estão ‘tentanto compensar’ a falta das demais (hipertrofia vicariante).
As mutações responsáveis pela DMD e pela DMB (Distrofia Muscular do tipo Becker) ocupam exatamente a mesma região no cromossomo X (a região Xp21). A partir de 1989. O antigo Laboratório de Genética da USP (atual Centro de Estudos do Genoma Humano da USP) passou a realizar exames de DNA para o diagnóstico das Distrofias de Duchenne e Becker.
Muitas fibras numa distrofia mostram alterações ditas ‘miopáticas’. Entre estas estão a presença de núcleos internos (não mais em posição subsarcolemal) e splitting ou partição da fibra em duas ou mais através de uma fenda longitudinal. Isto acontece principalmente em fibras hipertróficas.
O gene da DMD/DMB é gigantesco e em aproximadamente 65% dos pacientes afetados por estas doenças ocorre a perda de um pedaço do gene. É o que chamamos de deleção de DNA. Nos 35% restantes dos casos, ocorre um defeito menor, a que chamamos de mutação de ponto.
Em 1986 dois grupos de pesquisadores dos Estados Unidos identificaram e isolaram o gene da DMD e DMB. Isto significou um grande passo no conhecimento dessas doenças, tanto no diagnóstico quanto na detecção. A partir desta descoberta foram introduzidas novas técnicas de Biologia Molecular, o que possibilitou estudar diretamente o gene responsável pelas distrofias de Duchenne e Becker.
O gene responsável pela DMD foi clonado em 1987 e identificada a proteína que ele produz, a distrofina, cuja ausência acarreta as alterações musculares. A distrofina se localiza na membrana da célula muscular, e que faz parte de um complexo de várias proteínas que, em conjunto, participam da regulação da permeabilidade desta membrana. Hoje sabemos que a distrofina está ausente ou em quantidade muito reduzida nas células musculares dos pacientes de DMD, e alterada, porém parcialmente funcional, nos músculos dos afetados pela DMB.
Assim, a triagem de distrofina pode ajudar a distinguir as duas doenças. Ela também ajuda a distinguir ambas estas doenças de outras formas de distrofia muscular. Pois apesar de existirem outras, apenas na DMD e na DMB a distrofina é afetada.
Distrofina
A distrofina, cuja ausência ou alteração causa as distrofias musculares de Duchenne/Becker (DMD/DMB), faz parte de uma família de proteínas relacionadas, que incluem a utrofina, codificada por um gene autossômico, a merosina, componente da matriz extra-celular e o complexo composto por diferentes glicoproteínas associadas à distrofina (DAGs). O bom funcionamento do complexo seria responsável por um correto mecanismo de contração muscular, e alterações em diferentes proteínas do complexo têm sido observadas em diversas doenças neuromusculares.
A distrofina muscular tem vários domínios homólogos a outras proteínas do citoesqueleto , parecendo ser uma proteína estrutural com pelo menos dois papéis principais. Primeiro, é essencial para a manutenção da integridade da membrana muscular, ligando a actina do citoesqueleto à matriz extracelular. Segundo, ela parece ser necessária para a montagem da junção sináptica, pois os membros do complexo transmembranar participam do aglomerado do receptor de acetilcolina durante o desenvolvimento.
Em suma, as distrofinopatias incluem um conjunto muito específico de patologias, que se definem por mutações no gene responsável pela síntese da proteína distrofina. A distrofina participa do arranjo citoesquelético do miócito, ligando este ao sarcómero da matriz extracelular. Portanto, é uma proteína indispensável para o bom funcionamento do músculo esquelético em geral, uma vez que a sua falta possibilita um influxo de cálcio e outras moléculas provenientes do líquido extracelular para o interior das fibras musculares, culminando com a necrose dessas fibras.
As mutações em outras proteínas do complexo de glicoproteína da distrofina são responsáveis pelas formas autossômicas recessivas de distrofias musculares similares à Duchenne, como a distrofia muscular da cintura dos membros e outras distrofias.
“No músculo, a distrofina liga a matriz extracelular ao citoesqueleto de actina. A distrofina interage com um complexo multimérico composto de distroglicano (DAG), sacoglicanas, sintrofinas e distrobrevina formando um complexo glicoprotéico. O complexo α,β-distroglicano é um receptor de laminina e agrinina na matriz extracelular.”
Desenvolvimento da doença
Os meninos afetados são normais até 1 ou 2 anos de vida, mas desenvolvem fraqueza muscular por volta dos 3 anos (cerca de metade das crianças adquirem marcha independente até os 18 meses de idade), quando começam a ter dificuldades para subir escadas, correr, levantar do chão, quedas freqüentes e aumento característico do volume das panturrilhas. Embora existam variações na evolução do quadro clínico, normalmente os portadores de DMD não são capazes de continuar deambulando após os 16 anos de idade, pois freqüentemente a habilidade de andar é perdida entre 12 e 17 anos de idade.
Devido à natureza insidiosa, a DMD é normalmente suspeitada na época em que a criança começa a andar. As crianças podem apresentar déficit de equilíbrio, demora para deambular, dificuldades em subir escadas, fraqueza progressiva em membros inferiores, quedas freqüentes, bem como atraso do desenvolvimento psicomotor.
Um dos achados do estágio inicial da DMD é o aumento da musculatura da panturrilha. Esta freqüentemente acompanha o envolvimento da pelve. O aumento do volume muscular é causado pela proliferação anormal do tecido intersticial nas fibras do músculo gastrocnêmio. Observa-se firmeza e resistência à palpação da massa muscular, denominada pseudo-hipertrofia muscular, que também pode acometer outros grupos musculares.
O comprometimento muscular é simétrico e inicia-se pelos membros inferiores e quadris, e, mais tarde, atinge os membros superiores. Ocorre uma acentuação da lordose lombar e uma marcha anserina (andar de pato). Com o encurtamento dos músculos responsáveis pela flexão dorsal dos pés e para suportar melhor esta posição da pelve, a criança realiza uma
compensação alargando sua base de sustentação, que por sua vez induz a uma marcha do tipo anserina.
Marcha Anserina: Nela, há oscilações da bacia, as pernas estão afastadas, há hiperlordose lombar, como se o paciente quisesse manter o corpo em equilíbrio, em posição ereta, apesar do déficit muscular. A inclinação do tronco para um lado e para o outro confere à marcha a semelhança da marcha de um ganso, daí o nome de marcha anserina. Este tipo de marcha pode ser encontrada em qualquer processo que cause fraqueza dos músculos pélvicos, como nas polineuropatias pseudomiopáticas, miosites e polimiosites.
As deformidades ortopédicas são devidas às posições viciosas em nível de várias articulações. Tais posições viciosas levam freqüentemente à retrações músculo-tendinosas, envolvendo vários grupos musculares, agindo numa mesma articulação. As deformidades são progressivas e as alterações ósseas não são decorrentes da falha genética, mas decorrentes exclusivamente do desuso, incluindo a rarefação óssea encontrada nas extremidades dos ossos longos e chatos. Em estágios tardios, ocorre descalcificação e distorções grosseiras com desorganização do sistema esquelético. Essas alterações tornam os ossos desses pacientes bastante susceptíveis a fraturas por pequenos traumas.
A deformidade em tronco que gera conseqüências clínicas relevantes é o desvio lateral da coluna (escoliose) que, geralmente, aparece associado a uma rotação de tronco. Acreditava-se que a escoliose surgisse após a perda da marcha, relacionada com a postura inadequada em cadeiras de rodas. Contudo, alguns estudos descreveram o aparecimento de escoliose em crianças que ainda não haviam perdido a capacidade de deambular.
O comprometimento cardíaco ocorre em aproximadamente 50% a 85% dos casos de DMD. Os achados patológicos em músculo cardíaco incluem envolvimento da contratilidade ventricular, fibrose miocárdica focal localizada principalmente na parede ventricular esquerda e, eventualmente, taquicardia associada, embora os estudos de ecocardiografia demonstrem função miocárdica relativamente preservada.
Alguns autores afirmam que há também um comprometimento da musculatura lisa, paralelamente à degeneração da musculatura esquelética. Os principais sintomas relacionados são vômitos, diarréia, dilatação gástrica e distensão de cólon, sugerindo hipomobilidade gastro- intestinal, quadro que pode levar ao óbito.
Quanto ao comprometimento do Sistema Nervoso Central (SNC), os portadores de DMD apresentam discreta atrofia cerebral em 65% dos casos. Há freqüentemente um déficit intelectual destas crianças, com aproximadamente 75% apresentando coeficiente de
inteligência (QI) abaixo de 75.
As crianças com DMD também apresentam retardo no desenvolvimento do sistema locomotor e cognitivo, déficit de linguagem e de memória, bem como dificuldades de atenção. A prevalência de retardo mental moderado ou grave tem sido descrita em 30 a 50% dos casos.
A pseudo-hipertrofia das panturrilhas, o resultado de infiltração do músculo por gordura e tecido conjuntivo são vistos geralmente desde cedo. Alterações da coluna e dos tendões são conseqüência das alteraçoes musculares das pernas. Com o progredir da doença ocorre comprometimento dos músculos dos membros superiores. Há ainda amiotrofias predominantemente na cintura pélvica e escapular. Há progressão lenta com retrações tendíneas e perda da ambulação entre 8 e 12 anos.
A fraqueza excessiva evolui para incapacidade de andar, em geral no início da adolescência, embora a situação possa mudar graças à avanços da pesquisa voltada para o tratamento dos meninos afetados.
É improvável que o indivíduo com DMD sobreviva aos 20 anos de idade e a sobrevida além dos 25 é incomum. A morte se dá por insuficiência respiratória, broncopneumonia ou, como o miocárdio também é afetado, de insuficiência cardíaca. O cérebro é outro órgão afetado, em média ocorre uma redução de QI de cerca de 20 pontos.
Diagnóstico
Atualmente, o diagnóstico da Distrofia Muscular de Duchenne baseia-se no quadro clínico do paciente, na história familiar e nos seguintes exames complementares: dosagem dos níveis sangüíneos da enzima Creatinofosfoquinase (CK), que se encontram sempre muito elevados; exame de DNA para pesquisa de deleção no gene da distrofina; Biópsia muscular para o estudo qualitativo da proteína distrofina no músculo do paciente, especialmente nos casos em que o exame de DNA não identifica a deleção do gene da Distrofina.
Outra importante aplicação prática dos métodos de estudo de DNA é a detecção das mulheres portadoras pertencentes às famílias dos afetados. Atualmente, através destes métodos, é possível saber com certeza, na maioria dos casos, se uma mulher é portadora do gene da DMD. Para isso, utilizamos duas estrtégias de estudo:
1- se o paciente afetado apresenta uma deleção de DNA, podemos pesquisar diretamente a mesma deleção no DNA da mulher em risco na família. Em caso positivo, ela terá risco de 50% de ter filhos afetados e, se desejar, poderá se submeter a um diagnóstico pré-natal em uma futura gravidez.
2- Nas famílias onde não se identifica uma deleção no DNA do afetado, procuramos diferenciar o cromossomo X que contém o gene defeituoso do outro X (normal), através de marcadores polimórficos do cromossomo X. Este método é indireto e, por ser comparativo, exige coleta de sangue de várias pessoas da família. Por isso, é um estudo mais demorado e fornece resultados com uma confiabilidade de cerca de 95%. O Centro de Estudos do Genoma Humano da USP vem implantando novos métodos de estudo para a detecção das mutações de ponto no gene da Distrofina (para aqueles 35% dos casos onde não se detecta deleção de DNA). Um destes métodos, o Teste da Proteína Truncada (PTT), utiliza o RNA extraído dos linfócitos do sangue. Este método permite identificar o ponto exato onde ocorreu o erro (a mutação de ponto) dentro do gigantesco gene da Distrofina. Além da grande utilidade para o diagnóstico da DMD/DMB, este método também pode ser utilizado para a detecção de portadores, em casos onde antes não se identificavam deleções de DNA. Embora existam inúmeras pesquisas internacionais em andamento, com o objetivo de encontrar a cura da DMD, ainda não existe um tratamento específico para esta doença e a fisioterapia exerce um papel fundamental na melhora da qualidade de vida destes pacientes.
Tratamento
As distrofias musculares de Duchenne não têm cura. A fisioterapia e exercícios ajudam na prevenção da contratura muscular permanente em torno das articulações.
Às vezes a cirurgia torna-se necessária para a liberação de músculos contraídos e doloridos.
A prednisona, um corticoesteróide, vem sendo investigada como um meio de alívio temporário da fraqueza muscular.
Além disso, encontra-se sob investigação a terapia genética, que facilitaria a produção de distrofina pelos músculos. As famílias com membros que apresentam a distrofia muscular de Duchenne são aconselhadas a buscar um aconselhamento genético, para avaliação do risco de transmissão do traço da distrofia muscular aos descendentes.
As distrofias musculares são um grupo de distúrbios musculares hereditários que provocam fraqueza muscular de gravidade variável. Outros distúrbios musculares hereditários incluem as miopatias miotónicas, as doenças de depósito de glicogênio e a paralisia periodica.
Vigilância Respiratória
A assistência ventilatória é uma medida crítica em pacientes com DMD, pois aproximadamente 90% destes pacientes morrem devido a insuficiência respiratória crônica. Neste sentido, medidas de vigilância ajudam a identificar o início de complicações respiratórias, sendo de extrema valia para o ajuste da abordagem terapêutica.
A realização de mensurações frequentes da CVF é um método fácil de documentar a evolução da fraqueza dos músculos respiratórios. Deve-se estar atento ao surgimento de sintomas de hipoventilação noturna (Sonolência diurna, Excitação noturna frequente, dores de cabeça, Náusea, palpitações e redução do vigor diurno) ou a uma redução da CVF abaixo de 1,25 L ou abaixo de 40% do valor estimado para o paciente. Na vigência de suspeita de hipoventilação noturna, recomenda-se também a mensuração contínua da oximetria de pulso durante o sono para a identificação de insuficiência respiratória noturna.
Hipoventilação noturna sintomática é indicativa de ventilação não invasiva. VNI noturna também deve ser considerada caso o exame de polisonografia demonstrar baixa SPO2 ou alta PCO2. A presença de umaPCO2 Noturna de 55mmHg o paciente pode apresentar os sintomas de hipoventilação noturna, mesmo quando a mensuração dos gases arteriais durante o dia seja normal.
Prognóstico
A idade do óbito não está relacionada com a idade de início da manifestação da doença, e sim correlacionada com a idade em que a criança fica confinada à cadeira de rodas, ou seja, quanto mais cedo a criança parar de andar, pior o prognóstico.
A causa de óbito é freqüentemente relacionada às complicações cardiomiopáticas ou complicações respiratórias. Os problemas respiratórios decorrentes da DMD são relacionados a defeito restritivo causado por fraqueza dos músculos diafragmático, intercostais e acessórios, que irá levar a uma falência respiratória. Estima-se que 55 a 90% dos pacientes com DMD morrem por falência respiratória entre 16 e 19 anos e raramente após
os 25 anos de idade. A infecção pulmonar e/ou insuficiência respiratória são as causas mais freqüentes de óbito, ocorrendo em 75% dos casos. O óbito acontece entre a 2ª e 3ª décadas de vida, freqüentemente antes dos 21 anos de idade.
> Arquivos de Apresentações em ppt
> Arquivos de Resumos em pdf


