O processo cicatricial é comum a todas as feridas, independentemente do agente que a causou, é sistêmico e dinâmico e está diretamente relacionado às condições gerais do organismo. A cicatrização de feridas consiste em perfeita e coordenada cascata de eventos celulares, moleculares e bioquímicos que interagem para que ocorra a reconstituição tecidual.
A lesão tecidual – estímulo inicial para o processo de cicatrização – coloca elementos sangüíneos em contato com o colágeno e outras substâncias da matriz extracelular, provocando degranulação de plaquetas e ativação das cascatas de coagulação e do complemento. Com isso, há liberação de vários mediadores vasoativos e quimiotáticos que conduzem o processo cicatricial mediante atração de células inflamatórias para a região da ferida.
A cicatrização de feridas consiste em perfeita e coordenada cascata de eventos que culminam com a reconstituição tecidual.
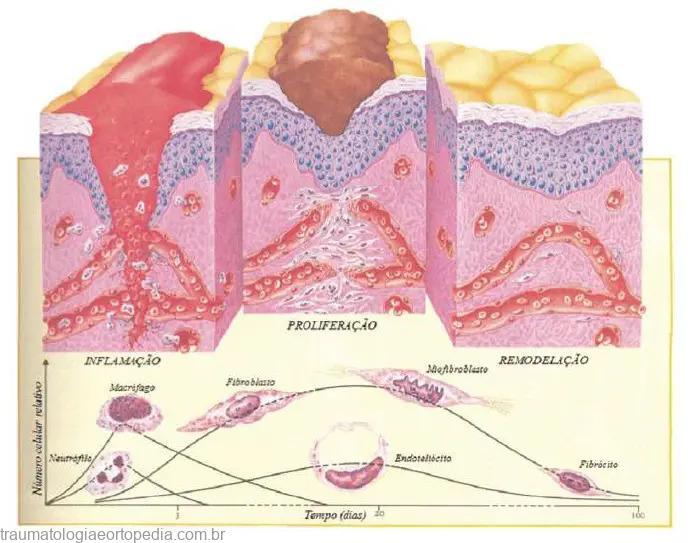
Os mecanismos da cicatrização em seqüência ordenada de eventos foram descritos por Carrel em 1910, e divididos posteriormente em cinco elementos principais: inflamação, proliferação celular, formação do tecido de granulação, contração e remodelamento da ferida. Recentemente, Clark reclassificou esse processo em três fases divididas, didaticamente, em: fase inflamatória, fase de proliferação ou de granulação e fase de remodelamento ou de maturação.
O processo de cicatrização é dividido didaticamente em três fases: inflamatória, proliferação ou granulação e remodelamento ou maturação. O colágeno é a proteína mais abundante no corpo humano e também é o principal componente da matriz extracelular dos tecidos. Estrutura-se numa rede densa e dinâmica resultante da sua constante deposição e reabsorção. O tecido cicatricial é resultado da interação entre sua síntese, fixação e degradação. Existem várias maneiras de avaliar a cicatrização das feridas. Os métodos mais utilizados atualmente são a tensiometria, a densitometria e morfometria do colágeno, a imunoistoquímica e, mais recentemente, a dosagem de fatores de crescimento.
Tipos de Cicatrização
1. Cicatrização por primeira intenção ou imediata (União primária)
- Incisão limpa em que as bordas estão aproximadas;
- Existe pouca perda de tecido;
- Pouco ou nenhum exsudato
- O edema é mínimo, não há infecção ou corpo estranho;
- O fechamento é relativamente rápido, de início com fibrina e formação de colágeno, prosseguindo à medida que ocorre impermeabilização da ferida;
- O fechamento total acontece em 48h, impedindo a instalação de bactérias;
- O tecido de granulação não é visível, e a mobilização da lesão é pequena;
- É o tipo de cicatrização cirúrgica.
2. Cicatrização por segunda intenção ou mediata (Contração e Epitelização)
- É aquela que permanece aberta;
- Onde existe uma perda significante de tecido e onde as fases de cicatrização são bastante marcadas;
- Resposta inflamatória bastante evidente, com necessidade maior de tecido de granulação, com epitelização visível;
- Há necessidade de um grande fortalecimento e um grande processo de contração;
- A cicatrização acontece tardiamente, muitas vezes com infecção associada, formação de tecido de granulação e posterior epitelização.
3. Cicatrização por terceira intenção
- Ferida que fica aberta por um tempo determinado;
- Ela ficará aberta só enquanto estiver com uma infecção real e depois ela irá se fechar.
Fases da cicatrização
Fase Inflamatória
Esta fase se inicia imediatamente após a lesão, com a liberação de substâncias vasoconstritoras, principalmente tromboxana A2 e prostaglandinas, pelas membranas celulares. O endotélio lesado e as plaquetas estimulam a cascata da coagulação. As plaquetas têm papel fundamental na cicatrização. Visando a hemostasia, essa cascata é iniciada e grânulos são liberados das plaquetas, as quais contêm fator de crescimento de transformação beta – TGF-β (e também fator de crescimento derivado das plaquetas [PDGF], fator de crescimento derivado dos fibroblastos [FGF], fator de crescimento epidérmico [EGF], prostaglandinas e tromboxanas), que atraem neutrófilos à ferida. O coágulo é formado por colágeno, plaquetas e trombina, que servem de reservatório protéico para síntese de citocinas e fatores de crescimento, aumentando seus efeitos. Desta forma, a resposta inflamatória se inicia com vasodilatação e aumento da permeabilidade vascular, promovendo a quimiotaxia (migração de neutrófilos para a ferida).
Neutrófilos são as primeiras células a chegar à ferida, com maior concentração 24 horas após a lesão. São atraídos por substâncias quimiotáticas liberadas por plaquetas. Os neutrófilos aderem à parede do endotélio mediante ligação com as selectinas (receptores de membrana). Neutrófilos produzem radicais livres que auxiliam na destruição bacteriana e são gradativamente substituídos por macrófagos.
Os macrófagos migram para a ferida após 48 – 96 horas da lesão, e são as principais células antes dos fibroblastos migrarem e iniciarem a replicação. Têm papel fundamental no término do desbridamento iniciado pelos neutrófilos e sua maior contribuição é a secreção de citocinas e fatores de crescimento, além de contribuírem na angiogênese, fibroplasia e síntese de matriz extracelular, fundamentais para a transição para a fase proliferativa.
Fase proliferativa
A fase proliferativa é constituída por quatro etapas fundamentais: epitelização, angiogênese, formação de tecido de granulação e deposição de colágeno. Esta fase tem início ao redor do 4º dia após a lesão e se estende aproximadamente até o término da segunda semana. A epitelização ocorre precocemente. Se a membrana basal estiver intacta, as células epiteliais migram em direção superior, e as camadas normais da epiderme são restauradas em três dias. Se a membrana basal for lesada, as células epiteliais das bordas da ferida começam a proliferar na tentativa de restabelecer a barreira protetora.
A angiogênese é estimulada pelo fator de necrose tumoral alfa (TNF-α), e é caracterizada pela migração de células endoteliais e formação de capilares, essencial para a cicatrização adequada.
A parte final da fase proliferativa é a formação de tecido de granulação. Os fibroblastos e as células endoteliais são as principais células da fase proliferativa. Os fibroblastos dos tecidos vizinhos migram para a ferida, porém precisam ser ativados para sair de seu estado de quiescência. O fator de crescimento mais importante na proliferação e ativação dos fibroblastos é o PDGF. Em seguida é liberado o TGF-β, que estimula os fibroblastos a produzirem colágeno tipo I e a transformarem-se em miofibroblastos, que promovem a contração da ferida.
Entre os fatores de crescimento envolvidos no processo cicatricial podem ser citados o PDGF, que induz a proliferação celular, a quimiotaxia e a síntese matricial; o fator epidérmico, que estimula a epitelização; o fator transformador alfa, responsável pela angiogênese e pela epitelização; o fator fibroblástico, que estimula a proliferação celular e angiogênese e o fator transformador beta, responsável pelo aumento da síntese matricial.
Fase de maturação ou remodelamento
A característica mais importante desta fase é a deposição de colágeno de maneira organizada, por isso é a mais importante clinicamente. O colágeno produzido inicialmente é mais fino do que o colágeno presente na pele normal, e tem orientação paralela à pele. Com o tempo, o colágeno inicial (colágeno tipo III) é reabsorvido e um colágeno mais espesso é produzido e organizado ao longo das linhas de tensão. Estas mudanças se refletem em aumento da força tênsil da ferida. A reorganização da nova matriz é um processo importante da cicatrização. Fibroblastos e leucócitos secretam colagenases que promovem a lise da matriz antiga. A cicatrização tem sucesso quando há equilíbrio entre a síntese da nova matriz e a lise da matriz antiga, havendo sucesso quando a deposição é maior. Mesmo após um ano a ferida apresentará um colágeno menos organizado do que o da pele sã, e a força tênsil jamais retornará a 100%, atingindo em torno de 80% após três meses.
Importância do colágeno
O colágeno é a proteína mais abundante do tecido conectivo em fase de cicatrização. As várias diferenças na sua composição química determinam as suas funções biológicas. Foram descritas até o presente 19 isoformas (tipos) de colágeno, codificadas por um único gene. Os tipos de fibras colágenas do tecido conjuntivo são helicoidais, com seqüência tripeptídica repetitiva composta de glicina-X-Y, sendo X representada pela prolina e Y pela hidroxiprolina. A rica presença de glicina e prolina é necessária para que uma molécula madura de colágeno assuma a estrutura de tripla hélice.
O colágeno tipo I é o mais freqüente, é sintetizado pelos fibroblastos, e é mais predominante em ossos e tendões. O tipo III é mais comumente encontrado em tecidos moles, como vasos sangüíneos, derme e fáscia. A derme sã contém aproximadamente 80% de colágeno tipo I e 20 % de colágeno tipo III. Já o tecido de granulação expressa 30 a 40 % de colágeno do tipo III, sendo considerado colágeno imaturo.
A degradação do colágeno se inicia precocemente e é muito ativa durante o processo inflamatório. A sua digestão ocorre em ambiente extracelular e é mediada por colagenases específicas. São conhecidos quatro tipos de colagenases: as séricas (elastase, catepsina C e proteinase neutra) e as metaloproteinases. A atividade das colagenases é controlada por citocinas liberadas principalmente por células inflamatórias, endoteliais, fibroblastos e queratinócitos. A formação da matriz extracelular é, pois, resultante de um balanço entre a deposição (síntese) e degradação de colágeno.
O colágeno é o principal componente da matriz extracelular dos tecidos. Estrutura-se em rede densa e dinâmica resultante da sua constante deposição e reabsorção. A quantidade de colágeno modifica-se no cólon durante o pós-operatório de anastomoses colônicas, principalmente na região peri-anastomótica. Essa variação é resultado da interação entre sua síntese, fixação e degradação no tecido cicatricial.
Fatores que influenciam a cicatrização
Fatores locais
Vários fatores podem influenciar negativamente a cicatrização, dentre eles os principais são: isquemia, infecção, técnica cirúrgica, corpo estranho e edema / pressão tecidual elevada.
Fatores sistêmicos
Sistemicamente, diversos fatores podem afetar de alguma maneira a cicatrização, dentre eles pode-se citar: diabete melito, deficiências vitamínicas, hipotiroidismo, doenças hereditárias (síndrome de Ehler-Danlos), alterações da coagulação, idade, trauma grave, queimaduras, sepse, insuficiência hepática e renal, insuficiência respiratória, tabagismo, radioterapia, desnutrição e o uso de corticosteróides, drogas antineoplásicas, ciclosporina A, colchicina e penicilamina.
Estudos experimentais comprovaram que a nicotina compromete o processo cicatricial. Skinovsky estudou, em 2000 e 2005, a influência a injeção de nicotina subcutânea na cicatrização das anastomoses de intestino delgado em ratos, e concluiu que os animais que receberam nicotina apresentaram cicatrização deficiente quando comparados ao grupo controle. Confirmando esses dados, Alves, em 2006, mostrou a cicatrização tecidual deficiente em ratos lactentes de mães que receberam nicotina subcutânea durante a gestação, representada pela redução da força de tração, da deposição de colágeno tipo III, da angiogênese e dos miofibroblastos.
Diversos medicamentos também foram avaliados. Em 2003, Bonin avaliou o efeito dos inibidores de bomba de prótons na cicatrização das anastomoses gástricas e concluiu que, juntamente com o aumento do pH intragástrico, ocorre melhora da cicatrização, com aumento da força de ruptura e da deposição de colágeno tipo III. Ainda na avaliação da cicatrização das anastomoses gástricas, em 2004, Trubian estudou o efeito do octreotide subcutâneo e concluiu que ele não altera a cicatrização gástrica. Entretando, Urdiales, em 2006, estudou o octreotide na cicatrização de anastomoses colônicas e concluiu que há melhora na deposição de colágeno tipo III, da força de ruptura e da força máxima de tração, melhorando a cicatrização.
Com as crescentes indicações para cirurgia no paciente com câncer, Vizzotto e Soares avaliaram a cicatrização das anastomoses após a injeção de quimioterápicos intraperitoneais e concluíram não haver diferenças significativas entre os grupos estudados. Ainda se falando de pacientes oncológicos, Ferreira, em estudo experimental concluiu que radioterapia pré-operatória e pós-operatória diminui a força necessária à ruptura total das anastomoses colônicas e a área percentual ocupada pelo colágeno tipo I (maduro) no 4º e 8º dia de pós-operatório.
A desnutrição protéica pode prejudicar a cicatrização de feridas por prolongar a fase inflamatória, diminuir a síntese e a proliferação fibroblástica, angiogênese e síntese de colágeno e proteoglicanos. Pode ainda reduzir a força tênsil de feridas, limitar a capacidade fagocítica de leucócitos e aumentar a taxa de infecção de feridas. Em 2004, Coelho-Lemos et al publicaram um estudo que avaliou a cicatrização de ratos neonatos de matrizes desnutridas e concluíram que a desnutrição intra-útero reduz a força na ferida abdominal desses ratos e que a deposição de colágeno é maior nestes animais, sugerindo que a ferida seja prioridade biológica. Gonçalves et al demonstraram, em 2005, que a desnutrição reduz a força de ruptura e a porcentagem de deposição de colágeno maduro nas anastomoses colônicas no 5º dia do pós-operatório. Também que a realimentação pré-operatória por sete dias aumenta a força de tração e a porcentagem de colágeno maduro24. Complementando o estudo de Gonçalves, Schmitz, em 2006, avaliou o efeito da suplementação com glutamina na cicatrização de anastomoses colônicas e concluiu que a suplementação leva a melhora da cicatrização com aumento da força máxima de tração e da deposição de colágeno tipo III.
Partindo do princípio da manipulação nutricional, diversos estudos foram realizados com fitoterápicos, mostrando seus efeitos na cicatrização. Dentre os fitoterápicos estudados, podem ser citar a Passiflora edulis (maracujá); Orbignya phalerata (babaçu) e a Jotropha gossypiifolia L.(pião roxo) e a Schimus terebinthifolius raddi (aroeira). Todos mostraram, de alguma forma, melhora na cicatrização da parede abdominal, anastomoses colônicas e gástricas, mediante avaliação histológica e ou da força de ruptura.


