Nos últimos anos, com o progresso do conhecimento científico, reconheceu-se a formação de biofilmes e seus potenciais danos para a saúde, em diversos segmentos de atividades humanas. Os biofilmes microbianos são comunidades de células aderidas a uma superfície e entre si e embebidas por uma matriz de substâncias extracelulares poliméricas. Estas substâncias poliméricas são produzidas pelos próprios microrganismos, com a finalidade de aumentar a sua chance de sobrevivência em um determinado meio. Estas substâncias de produção microbiana são também denominadas slime.
Na natureza, as bactérias que vivem livres em um meio líquido, onde estão dispersas, são denominadas como bactérias planctônicas. Quando estas bactérias planctônicasestão aderidas a uma superfície, passam a ser denominadas de bactérias sésseis. No estado séssil estas bactérias se diferenciam da sua condição planctônica, porque vivendo em comunidades estruturadas passam a adquirir algumas vantagens de sobrevivência.
Qual é a composição do biofilme e como ele se forma?
O biofilme pode apresentar uma ou mais espécies de microrganismos, dependendo do seu tempo de duração e sua localização. Pode envolver bactérias Gram-positivas, Gram-negativas e leveduras. Além de bactérias, outros elementos celulares podem estar agregados no biofilme, como plaquetas, por exemplo, quando o biofilme está instalado em superfície banhada por sangue.
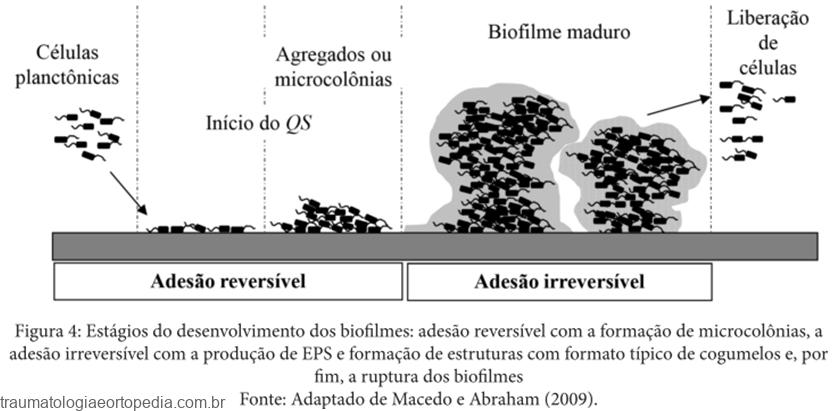
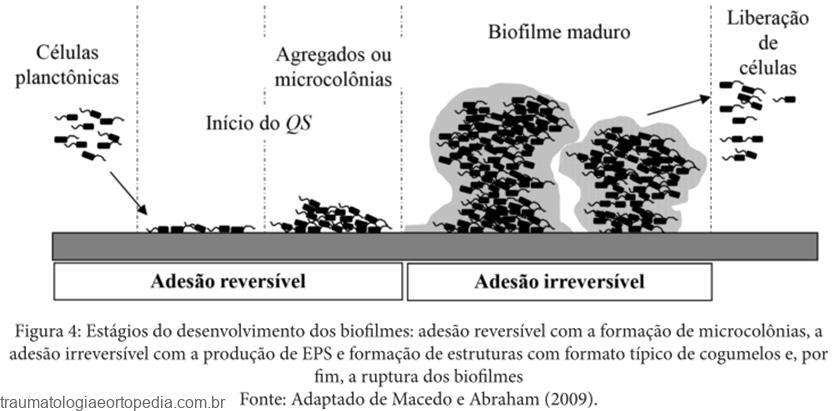
A primeira fase da formação do biofilme é a adesão primária a uma superfície. Esta adesão irá depender tanto de elementos microbianos, como do tipo de superfície e do ambiente no qual a superfície está inserida.
A adesão das células microbianas a uma superfície pode se dar ao acaso ou ser induzida por quimiotaxia em função das características químico-físicas da superfície. A composição da superfície determina interações eletrostáticas ou hidrofóbicas que podem favorecer a formação de biofilmes. Portanto, determinados tipos de materiais predispõem à formação de biofilmes, como certos polímeros. Por outro lado, acredita-se que superfícies impregnadas com antimicrobianos ou prata poderiam produzir uma interação desfavorável à deposição celular. Nesta fase de adesão, a interação com estruturas do hospedeiro, como plaquetas e fibrinas, tendem também a favorecer a formação do biofilme. Contam para o processo de adesão alguns elementos de virulência de microrganismos, denominadas adesinas, que são os pilis e as fimbrias.
A partir de então, ocorre a adesão secundária, também chamada de ancoragem, quando as células microbianas passam a produzir a matriz de polissacarídeo agregando os elementos ancorados no biofilme. Esta adesão secundária, portanto, gera uma firme camada de elementos sólidos, onde se encontram embebidos na matriz de polissacarídeo os elementos celulares bacterianos e os do hospedeiro. A coesão de todos estes elementos entre si e a sua adesão à superfície são tão poderosas que muitos autores consideram que, uma vez formado, o biofilme será irreversível.
Diversos fatores contribuem para a velocidade da formação de biofilmes. Esta taxa deadesão depende primariamente do número e tipo de células presentes no líquido ao qual a superfície está exposta e da taxa de fluxo deste líquido através da superfície. As propriedades físico-químicas da superfície, a composição nutricional e temperatura do ambiente também irão interferir nesta velocidade. A presença de antimicrobianos no meio pode afetar a formação de biofilmes.
Alguns microrganismos, pelas suas características fenotípicas e genotípicas, estão mais freqüentemente associados à produção de biofilmes. São eles: Candida albicans, Staphylococcus coagulase negativa, Enterococcus spp, Klebsiela pneumoniae, Pseudomonas aeruginosa e Staphylococccus aureus.
O biofilme, em geral, possui uma aparência viscosa, constituída por um aglomerado de biopolímeros altamente hidratados, coletivamente chamados de substâncias poliméricas extracelulares (EPS, do inglês Extracellular Polymeric Substances). Dentre essas substâncias há compostos como DNA, proteínas, lipídeos e carboidratos, liberados pelas bactérias do biofilme.
Biofilmes são, de forma simplificada, “um amontoado de microrganismos” e qualquer tipo de substância orgânica que possa ser secretada por eles. Mas, engana-se quem pensa que não há organização nesta estrutura: existe uma complexo mecanismo de expressão gênica envolvido na formação, manutenção e comunicação dentro de biofilmes. Algumas substâncias são produzidas especialmente para formação da matriz extracelular. Outros polímeros complexos garantem a adesão e coesão da estrutura para que o biofilme se mantenha firme e definido, com as condições ideais de sobrevivência e crescimento para os microrganismos ali presentes.
Através do biofilme as bactérias conseguem se fixar tanto em superfícies bióticas (como dentes e sistema intestinal de mamíferos) quanto abióticas (rochas, plásticos e encanamentos, por exemplo). Essas estruturas se formam principalmente em superfícies onde há interface entre sólido e líquido. A composição das substâncias da matriz pode variar muito entre cada biofilme, pois depende tanto de fatores externos (temperatura, radiação, tipo de substrato, entre outros) como das espécies que estão abrigadas na estrutura.
Em geral, os biofilmes na natureza abrigam diferentes espécies de microrganismos, os quais podem viver tanto em um equilíbrio inicial quanto, mais frequentemente, competindo pelo espaço. Os microrganismos correspondem a cerca de 10% da massa seca de um biofilme, o restante é matéria EPS. Podem incluir não apenas bactérias, mas também fungos e algas.
Microrganismos
Os estafilococos são os microrganismos mais diagnosticados nas infecções associadas aos biomateriais, sendo S. epidermidis e S. aureus responsáveis por 60 a 70% dos casos.
Apesar de raramente associar-se a infecções comunitárias, o S. epidermidis é observado com frequência nas infecções em unidades de tratamento intensivo. Isso se deve, provavelmente, à sua capacidade de aderir e formar uma espessa matriz extracelular com múltiplas camadas sobre a superfície de polímeros. Estudos in vitro mostram que S. epidermidis adere preferencialmente à superfície de polímeros, enquanto S. aureus à superfície metálica.
Outras espécies de bactérias também estao relacionadas a tais processos infecciosos, como a colonização de lentes oculares por P. aeruginosa. Os Streptococcus spp. e Enterococcus faecalis, além das bactérias anaeróbias, principalmente a Proprionobacterium acne, têm apresentado incidência crescente.
O S. aureus e os bacilos Gram-negativos predominam nas infecções pós-cirúrgicas precoces (até três meses após a cirurgia), enquanto microrganismos menos virulentos como os estafilococos coagulase negativo e Proprionobacterium acnes estao mais associados a infecções cirúrgicas tardias.
Patogênese da infecção periprotética
A adesão bacteriana aos diversos biomateriais e a formação de biofilmes na superfície dos implantes são passos fundamentais na patogênese dessas infecções. A maioria dos casos de contaminação ocorre durante a sua colocação, por contato direto do biomaterial com o meio externo ou com tecidos colonizados como a pele. A adesão, após o contato, ocorre em duas fases distintas: inicialmente, pela atração física entre o germe e o implante (fase reversível); e tardiamente, caracterizada pela interação celular e molecular com a superfície do biomaterial (fase irreversível).
Fase 1
Nesta etapa, as forças físicas são mais ativas do que a quimiotaxia ou efeitos moleculares. A atração sofre efeito de forças de atração de “longas distâncias” (>50 nm), descritas como forças mútuas, em função da distância e da energia livre, e “curtas distâncias” como forças de Wan der Walls, eletrostáticas (iónicas, dipolos e interações hidrofóbicas) e covalentes. Dessa forma, os aspectos biofísicos da superfície dos implantes e a concentração bacteriana são fatores determinantes para a adesão definitiva do microrganismo, que podem interagir diretamente com a superfície ou com macromoléculas provenientes do hospedeiro (ex: proteínas, glicoproteínas) aderidas à sua superfície.
Ainda não houve interação molecular entre o microrganismo e o biomaterial e não há formação de biofilmes. O uso de correntes elétricas <100µA na fase inicial de adesão é capaz de reduzir o número de bactérias viáveis sobre a superfície do biomaterial em mais de 75% da concentração inicial. Como a adesão ainda não é definitiva, essa fase é considerada “reversível”, sendo que medidas físicas como a lavagem, defesas do hospedeiro e antimicrobianos são capazes de evitar a evolução para infecção.
Fase 2
A segunda fase representa a interação molecular e celular do microrganismo com a superfície do biomaterial ou proteínas adsorvidas a ela, como a fibronectina e o colágeno. Nessa etapa predominam as reações moleculares que permitem a adesão firme da bactéria à superfície do implante. As estruturas responsáveis pela adesão são as adesinas, que produzem interação molecular com tecidos adjacentes do hospedeiro, permitindo a formação de uma matriz extracelular conhecida como biofilme. Patógenos específicos, como S. epidermitis, têm sua virulência aumentada por genes que codificam essas adesinas. Durante as várias fases da infecção, diferentes genes são expressos, o que possibilita: a) o tropismo do microrganismo a localidades anatômicas específicas; b) a capacidade das células de se organizarem em biofilmes com matrizes extracelulares; c) o rompimento do biofilme, uma vez que a densidade celular adequada é obtida permitindo-se a disseminação da infecção a sítios adjacentes.
Fatores que influenciam a adesão bacteriana
A adesão bacteriana é processo complexo e influenciado por vários fatores do microambiente como temperatura, concentração de microrganismos, tempo de exposição, condições teciduais, proteínas teciduais e plasmáticas, características das bactérias e dos materiais, pH e antimicrobianos.
Fatores bacterianos
Os principais fatores dos microrganismos que influenciam a adesão bacteriana são a carga elétrica de sua membrana, a hidrofilia e a capacidade de interação com proteínas do hospedeiro.
A carga elétrica da superfície bacteriana varia com a espécie, com as condições do meio e com a composição de sua membrana. Em geral, bactérias suspensas em meio aquoso tendem a ter sua superfície carregada negativamente. Esse perfil parece influenciar na fase inicial de adesão (fase reversível), sendo que a formação do biofilme reduz a ação de correntes elétricas sobre a adesão. A importância do carregamento elétrico da superfície bacteriana, entretanto, ainda não está muito bem esclarecida.
A hidrofilia também influencia a adesão bacteriana. Em geral, bactérias com características hidrofóbicas e hidrofílicas preferem superfícies com propriedades hidrofóbicas e hidrofílicas, respectivamente. As superfícies hidrofóbicas parecem ser mais susceptíveis à colonização.
A capacidade de interagir com proteínas séricas ou teciduais presentes no momento da contaminação bacteriana parece ter importante influência na adesão, sendo que a maioria dessas interações acontece por presença de receptores específicos. Algumas das interações aumentam a adesão, como as que envolvem fibronectina, fibrinogênio ou trombina, ou inibem, como as que envolvem a albumina. A fibronectina está envolvida em mais adesão de S. aureus à superfície de substratos, pela ligação específica, tempo-dependente e irreversível. A influência da fibronectina em relação à adesão de S. epidermidis ainda é controversa. O fibrinogênio favorece a adesão bacteriana aos biomateriais, principalmente quando se trata dos estafilococos. A trombina, por sua vez, favorece a adesão bacteriana ao converter fibrinogênio em fibrina, que envolve o agregado plaquetário, estabilizando o trombo e favorecendo a adesão das bactérias. A albumina adsorvida à superfície material tem mostrado efeito inibitório sobre a adesão nas superfícies cerâmicas, metálicas e de polímeros.
Fatores dos biomateriais
As duas características dos biomateriais que mais influenciam na sua capacidade de interagir com microrganismos são a sua composição química e a sua superfície.
Os componentes químicos que formam o implante podem resultar em mais adesão bacteriana ou na sua inibição. De maneira geral, os implantes são compostos de polímeros (poliuretanos, polietilenos, acrílicos) ou de ligas metálicas (aço, titânio, cromo-cobalto). Os polímeros necessitam de menos concentração bacteriana para a ocorrência de infecção do que os metais. Observa-se, também, preferência de adesão aos polímeros por S. epidermidis e por Escherichia coli, enquanto os metais são mais passíveis de adesão por S. aureus. Os componentes acrílicos são mais facilmente colonizados quando comparados aos polietilenos.
Entre os metais, as ligas de titânio são menos propensas às infecções quando comparadas às de aço e de cromo-cobalto. Isso ocorre pela melhor biointegração do titânio, mais inerte quando implantada em tecidos humanos. Ligas que apresentam reduzida integração com células do hospedeiro, como as de cromo-cobalto, dispõem de mais energia livre em sua superfície, o que permite mais colonização bacteriana. Têm sido demonstrados efeitos da prata (Ag) na inibição da colonização de biomateriais.
As características da superfície do implante é outro importante fator influente no mecanismo de adesão. As superfícies porosas são mais propensas à adesão quando comparadas a superfícies polidas. Isso se deve tanto ao aumento da área quanto à melhor adaptação da bactéria a porosidades semelhantes ao seu tamanho.
Fatores do microambiente
O antibiótico é fator que pode influenciar a adesão bacteriana, dependendo da susceptibilidade do microrganismo e da concentração da droga. Os S. epidermidis aderidos são menos susceptíveis ao tratamento com antibióticos do que células não aderidas, sendo reduzida quando os cateteres são impregnados com rifampicina-sparfoxacin.
A concentração de eletrólitos, tais como KCl e NaCl, assim como o pH no meio de cultura, também influencia a adesão bacteriana. A força iónica e o pH interferem tanto nas características da superfície bacteriana quanto do material (hidrofobicidade – carga), modificando, portanto, as interações da fase 1.
Como prevenir a formação de biofilmes?
A prevenção de formação de biofilmes deve ser focada em dois aspectos principais: a) redução ao máximo da presença de microrganismos no ambiente; b) desenvolvimento de novos produtos com superfícies ou condições especiais que desfavorecem a adesão primária.
No primeiro aspecto estão as práticas ótimas de prevenção de infecção, tendo por princípio reservar a implementação de dispositivos invasivos para as situações absolutamente imprescindíveis, cuidando para interromper a utilização destes dispositivos tão logo seja possível. Além disto, as boas práticas de manejo de pacientes, artigos e ambientes, com ênfase na higiene das mãos e manuseio asséptico de itens esterilizados é essencial. Em muitas situações há que se controlar a carga microbiana presente na água. No segundo aspecto, muitas pesquisas vem sendo realizadas com o intuito de desenvolver dispositivos com superfícies que promovam uma interação eletrostática desfavorável ou com impregnação de agentes germicidas como a prata, o iodo e outros antimicrobianos. Ainda, pesquisa-se substâncias que possam inibir a formação do biofilme ou mesmo dissolvê-lo. Entretanto, mesmo que estes recursos tecnológicos estejam disponíveis, a efetividade dos mesmos será reduzida se as boas práticas de prevenção de infecção não prevalecerem.
Saiba mais:
Infecção pós-operatória em cirurgia ortopédica